 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 42 篇 doi: 10.5376/mpb.cn.2011.09.0042
收稿日期: 2011年02月16日 接受日期: 2011年03月28日 发表日期: 2011年04月12日
张作青等, 2011, 转il-4基因大白菜(Brassica Pekinensis Rupr.)分子检测及遗传和表达研究, 分子植物育种 Vol.9 No.42 (doi: 10.5376/mpb.cn.2011.09.0042)
以花粉管通道法转化得到的转il-4基因大白菜哈白二号、潍白六号和新世纪三个品种为试验材料,通过PPT抗性筛选、PCR扩增、PCR-Southern杂交和Western杂交等技术,对转il-4基因大白菜后代进行分子检测,并研究了il-4基因在T6代自交大白菜中的传递规律及对T6代植株表型、抗病性进行了调查。经检测共得到22个株系的63株阳性植株,其中il-4基因的抗性分离情况均不符合"抗性植株:非抗性植株=3:1"的孟德尔分离规律。与非转基因大白菜相比,转il-4基因阳性植株生长势较弱,抗病性较差。统计分析显示,通过花粉管通道法对三个品种的大白菜进行遗传转化,在相同的转化处理时机,三个品种间的转化率差异不显著。结果证实通过花粉管通道法介导的il-4基因可以在大白菜中遗传并表达。
大白菜(B. pekinensis Rupr.)又名结球白菜,原产我国,是十字花科芸薹属两年生草本植物,在我国栽培广泛,是重要的蔬菜作物之一。大白菜营养丰富,并且具有一定的药用价值。20世纪80年代,随着大白菜组织培养与高频植株再生体系的逐步建立,在此基础上国内外学者进行了大量的转基因研究,已经由大白菜真叶(成细华, 2001)、子叶(王洋, 2005)、下胚轴(卢永恩, 2003)、花药(Sylvie, 2004)及小孢子(申书兴, 2006)等外植体得到了再生植株。目前,随着对转基因蔬菜的研究不断深入,转基因大白菜在抗虫(谢建坤, 2001)、抗病(杨广东, 2002)、抗除草剂(王雷, 2006)等方面的相关分子标记与检测不断成熟,利用转基因技术及其分子检测与标记在其它作物如番茄(及晓宇, 2009)、甘蓝(吕俊, 2001)、甘蓝型油菜等(Londo, 2011)也取得了一定进展。
人白细胞介素4 (Interleukin, IL-4),是由T细胞产生的细胞因子,分子量为15 KD,结构复杂,功能广泛。IL-4能调节B细胞的生长分化及其对抗原刺激的应答、防止T淋巴细胞凋亡、促进巨噬细胞提呈抗原、刺激肥大细胞的增殖。其中最主要的功能是增强B细胞对T细胞的相互作用及促进IgE介导的免疫应答反应。另外,IL-4在过敏性和感染性及自身免疫性疾病、肿瘤等方面都具有重要的医疗价值。
本实验室利用花粉管通道法将il-4基因转入大白菜中,对其自交后代T6代植株进行分子生物学活性检测和遗传表达研究。试图为今后进一步利用转il-4基因大白菜提供参考。
1结果与分析
1.1转il-4基因大白菜T6代幼苗的PPT抗性筛选
按照品种的不同,对T5代种子4℃春化处理30 d后,播于温室288孔育苗盘中,共播T5代种子1413粒,获得T6代幼苗935株;经PPT抗性筛选,反应10 d左右后淘汰叶片枯黄死亡的植株(图1),共获得具PPT抗性阳性植株588株(表1)。
 图1 转il-4基因大白菜T6代幼苗的PPT抗性筛选 注: A: 喷洒PPT之前; B: 喷洒PPT 10 d后 Figure 1 PPT resistance selections of il-4 transgenic Chinese cabbage (T6 generation) Note: A: Before spraying PPT; B: After spraying PPT for ten days |
 表1转基因大白菜T6代检测结果 Table 1 Examination results of transgenic plants in T6 generation |
1.2转il-4基因大白菜T6代幼苗的PCR检测
分别以rbcl和il-4基因特异性引物对T6代大白菜幼苗进行内对照和il-4 PCR检测,分别得到了大小为433 bp和243 bp的特异性条带(图2),共获得il-4阳性植株45株(表1)。阳性率仅为4.81%,远远低于孟德尔定律理论值75%。
 图2 转基因大白菜内对照及il-4基因的PCR扩增 注: A: rbcl 基因扩增; 1~15: 转基因大白菜; 16: 空白对照; 17: 非转基因材料阴性对照; B: il-4 基因扩增; 1: 阳性对照(质粒); 2: 阴性对照(非转基因材料); 3: 空白对照(水); 4~24: il-4阳性植株; M: DL2000 marker Figure 2 PCR amplification of il-4 and rbcl gene in transgenic Chinese cabbage Note: A: PCR amplification of rbcl gene; 1~15: Transgenic plants with il-4; 16: Blank control; 17: Non-transgenic plants. B: PCR amplification of il-4 gene; 1: Positive control (Plasmid); 2: Negative control (Non-transgenic plants); 3: Blank control (Water); 4~24: Transgenic plants with il-4; M: DL2000 marker |
1.3转il-4基因大白菜的PCR-Southern杂交
PCR-Southern杂交结果表明,阳性对照(质粒)与7个PCR三次阳性样品中的6个出现杂交信号,1号空白和10号阴性对照没有条带。PCR检测结果无污染,初步证明il-4基因已经整合到大白菜基因组中(图3)。
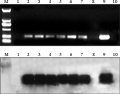 图3 转il-4基因大白菜的PCR扩增、PCR-Southern杂交结果 注: 1: 空白对照(水); 2~8: il-4 阳性植株; 9: 阳性对照(质粒);10: 阴性对照(非转基因材料); M: DL2000 marker Figure 3 PCR amplification and PCR-Southern detection of il-4 transgenic Chinese cabbage Note: 1: Blank control; 2~8: Positive plants of il-4; 9: Positive control; 10: Negative control; M: DL2000 marker |
1.4 转il-4基因大白菜的Western杂交
为进一步确证il-4基因在大白菜中的表达,对部分PCR-Southern杂交呈阳性的样品进行Western杂交,结果在PVDF膜上出现杂交条带(图4),大小与IL-4标准蛋白一致(约15 KD),阴性对照样品无杂交条带。通过Western杂交结果,进一步验证了上述PCR、PCR-Southern杂交结果的可靠性。同时证明il-4基因能够在转基因大白菜中正常表达。
 图4 转il-4基因大白菜的Western杂交结果 注: M: 蛋白分子量marker; 1: il-4标准品; 2~6: 转基因植株;7: 非转基因材料阴性对照 Figure 4 Western blotting of transgenic Chinese cabbage with il-4 Note: M: protein molecular weight marker; 1: il-4 standard; 2~6: Transgenic plants; 7: Non-transgenic control |
1.5转il-4基因大白菜的生长势与抗病性调查
通过田间调查表明,与非转基因植株相比,转il-4基因阳性大白菜植株的生长势变弱、个体矮小、抗病性下降(图5)。
 图5 转il-4基因大白菜的生长势与抗病性 注: A, C: 阴性对照植株; B, D: il-4阳性植株 Figure 5 Growth vigor and disease resistance of transgenic Chinese cabbage with il-4 Note: A, C: Negative control plant; B, D: Positive plants of il-4 |
1.6不同转化时机对il-4转化率的影响
将哈白二号在花期不同时机授粉的il-4阳性率进行χ2独立性检验(表2)。统计结果表明,在花期进行人工授粉后24 h左右进行转化操作(AH)的il-4转化率显著高于12 h左右进行转化操作(BH)。
表2 不同转化处理对阳性率的影响 注: χ21, 0.05=3.841; χ21, 0.01=6.635 Table 2 Different treatment combination effects on positive rate Note: χ21, 0.05=3.841; χ21, 0.01=6.63 |
1.7 不同品种对il-4转化率的影响
将哈白二号与潍白六号在相同转化处理时期的il-4阳性率统计并进行χ2独立性检验(表3)。结果表明,在AH转化处理下,哈白二号与潍白六号的阳性率差异不显著,其中哈白二号的阳性率较高,为8.56%。
表3 不同品种对阳性率的影响 注: χ21, 0.05=3.841; χ21, 0.01=6.635 Table 3 Different varieties effects on positive rate Note: χ21, 0.05=3.841; χ21, 0.01=6.635 |
2讨论
2.1关于il-4基因在大白菜后代传递规律的讨论
在本试验中,T6代大白菜的il-4基因分离情况严重偏离3:1的孟德尔遗传定律,很可能是转基因的失活、纯合体致死效应及一些未知的原因,导致在自交高世代中也往往得不到纯合体或者无法得到纯合体(Budar, 1986)。其次,外源基因在自交传递过程中的丢失与外源基因不能通过花粉有效传递也可能造成非孟德尔遗传现象,丢失的原因可能是转育过程中,由于基因互作,导致基因片断丢失,也可能是il-4基因在转化时未整合到大白菜的基因组中,在生殖细胞形成过程中,il-4基因可能没有正常分配给雌雄配子,造成基因丢失(华志华等, 2003; Huaijun, 2005)。
近年来,转基因工程发展迅速,许多植物的遗传转化相继获得成功。但也有研究表明,在高等植物中,30%的转基因实验都发现了基因沉默现象。引起基因沉默的原因很多,转基因的拷贝数和构型、在植物上的整合位点、转录水平等都与沉默有关,外界环境如温度过高、光照过强也会增加基因沉默发生的几率和产生时间(吴迪, 2002)。除此以外,一些人为因素也可能导致实际观察到的比例值偏低,如PPT抗性筛选时,对植株叶面直接喷洒筛选剂的方法简单且易于操作,但是可能造成敏感植株的死亡,很难准确揭示遗传规律的真实性。
2.2 il-4基因在大白菜后代中表达讨论
外源基因能否在受体植株内表达并最终合成目的蛋白是转基因技术的直接目标。检测整合的基因是否表达,通常会用到的方法有定量的ELISA检测及定性的Western杂交等(及晓宇等, 2009)。本试验中对五株PCR-Southern杂交呈阳性的样品进行Western杂交,结果三株出现杂交条带,基本证明了il-4基因已经成功转入大白菜并表达。其余未出现杂交带的可能是表达量过低所致。IL-4在总可溶性蛋白中的表达量相对较低可能有如下几方面原因:首先,细胞中存在大量的蛋白酶,可能会降解外源基因的表达产物,从而使目的蛋白不能在植物细胞中有效累积。其次,本试验中的转基因大白菜是由花粉管通道法介导的遗传转化得到的,il-4基因可能整合到异染色质上,而这些异染色质的转录活性低,甲基化程度高,导致il-4不能正常表达。最后,植物对密码子有一定的偏爱性,本试验中植物表达载体采用35S启动子,并添加2倍增强子序列,但il-4可能不符合大白菜对密码子的偏爱性,从而影响IL-4表达量和mRNA的稳定性(Wally et al., 2008)。
2.3 关于不同转化处理对IL-4阳性率的影响的讨论
不同转化时机对il-4转化率有影响,统计分析显示哈白二号在花期进行人工授粉后24 h左右进行转化操作(AH)的il-4阳性率显著高于12 h左右进行的转化操作(BH),根据花粉管通道法的转化机理,在花期授粉后12h~24 h时进行转化操作时的转化率差异不大(彭杰, 2004)。本试验中,哈白二号BH处理组合阳性率偏低,可能是由于PPT抗性筛选或PCR检测中出现假阴性,导致阳性个体太少,转化率偏低。
2.4 关于不同品种对il-4转化率影响的讨论
统计分析发现,在转化处理组合相同且为AH时,哈白二号的il-4阳性率比潍白六号高,但两个品种差异不显著。原因可能是il-4整合到大白菜基因组中没有品种特异性,在后代的遗传中可能以相似的规律分离(王雷等, 2006)。
2.5 关于大白菜自交不亲和性的讨论
自交不亲和现象在被子植物中广泛存在,特别是十字花科最为普遍,大白菜为十字花科异花授粉植物,其原种经多代自交以后,一般会引起生活力衰退,表现出生长势差、抗病力减弱、结实率降低等,这样必然会影响到育种等相关研究。本试验也基本证实了这一现象:大白菜自交高世代T6代阳性率低,田间调查显示,与非转基因植株相比,转il-4基因大白菜生长势减弱、植株矮小、抗病性下降。吕俊等利用蛋白激酶抑制剂(槲皮素)和蛋白激酶激活剂(佛波酯)分别对甘蓝自交不亲和系与自交亲和系花蕾进行田间处理,结果自交不亲和系的自交亲和指数与对照相比有所提高,甚至转变为自交亲和系(吕俊等, 2001)。除了利用激素等化学方法抑制植物的自交不亲和性外,一些生物学方法如延迟授粉、染色体加倍等也可以克服自交不亲和性(赵军良, 2006)。
近年来,随着转基因技术日渐成熟,利用基因工程技术培育抗虫抗病新品种是将来农业发展的一个重要方向,建立高效稳定的遗传转化体系对大白菜的品种改良和增强抗虫抗病能力显得尤为重要。另外,利用大白菜的杂种优势,对已经检测的转基因阳性植株不同品种、株系间进行杂交,避免自交衰退,试图选育出高表达植株,用于药用蛋白的生产,这也将是我们今后对转基因大白菜研究的一个趋势。
3实验材料与方法
3.1供试材料
供试材料为大白菜三个品种:哈白二号(代号H2)、潍白六号(代号W6)、新世纪(代号XSJ),其原种由哈尔滨市农业科学院提供。进行分子检测的材料为经PPT筛选的大白菜T6代自交株系植株幼苗;携带il-4基因的大白菜通过花粉管通道法介导转化而来,转化质粒为P4IL4,该质粒的部分图谱见图6。
 图6 P4IL4质粒部分图谱 Figure 6 part of P4IL4 plasmid map |
3.2 方法
3.2.1 转il-4基因大白菜的春化与授粉
将大白菜种子充分湿润后在25℃恒温培养箱中浸种12 h左右,待大部分种子露白时,将种子用厚毛巾包好放入4℃冰箱中春化处理30 d。春化处理时要注意始终保持种子湿润,但也要注意温度不能过低,以免冻坏种子,待大白菜生长至抽薹开花期,进行人工自交授粉。
3.2.2 转il-4基因大白菜的PPT抗性筛选
待大白菜长出两片真叶时,用300mg/L~350 mg/L 的PPT(爱诺园草净)喷洒叶面,并且加入0.1%吐温-20以增加试剂在叶片的附着力。强日照条件下反应10 d,淘汰枯黄死亡的植株。
3.2.3 转il-4基因大白菜基因组DNA的制备
以CTAB法(凌春莹等, 2005)提取筛选得到的大白菜T6代PPT抗性植株的基因组DNA。
3.2.4 转il-4基因大白菜的PCR检测
为了检测模板DNA质量,排除由模板中杂质影响而造成的假阴性结果,以待测大白菜总DNA为模板,进行内对照PCR。阳性对照、阴性对照、空白对照分别为P4IL4质粒、非转基因大白菜和水。之后对T6代大白菜进行il-4基因的PCR检测。内对照引物和il-4基因引物的扩增产物长度分别为433 bp和243 bp。内对照与il-4 PCR的反应体系见表4,反应条件见图7。
 表4 内对照、il-4 PCR反应体系 Table 4 PCR reaction system of rbcl and il-4 gene |
 图7 内对照、il-4 PCR反应条件 Figure 7 PCR reaction conditions of rbcl and il-4 gene |
用1~1.2%的琼脂糖凝胶电泳检测结果。将三次均扩增出il-4基因特异性条带的植株视为阳性株。
3.2.5 转il-4基因大白菜的PCR-Southern杂交
以PCR扩增得到的T6代大白菜il-4阳性植株的基因组DNA为待测样品,进行PCR-Southern杂交,对照组的设置与PCR检测相同。操作步骤参照《DIG High Prime DNA Labeling and Detection Starter KitⅠ》(Roche公司)。
3.2.6 转il-4基因大白菜的Western杂交
为了进一步确定il-4基因在转基因植株中是否表达,对经PCR、PCR-Southern检测的部分il-4阳性植株进行Western杂交。按直接提取法提取转基因大白菜蛋白粗提液,参照《分子克隆实验指南》对转il-4基因大白菜进行Western杂交(J.萨姆布鲁克, 1992)。
3.2.7 转il-4基因大白菜的生长势与抗病性调查
将转il-4基因大白菜植株和非转基因植株均定植于哈师大标本园,常规露地田间管理,对植株生长势、抗病性进行调查。
3.2.8 试验数据的统计分析
对不同品种、不同转化处理对il-4转化率的影响,采用χ2独立性检验进行统计分析。
作者贡献
张作青是本研究的实验设计和实验研究的执行人,并且完成数据分析、论文初稿的写作,张玮滢参与实验设计试验结果分析,于丽杰是项目的构思者及负责人,指导实验设计,数据分析,结果分析,论文写作与修改。全体作者同意并阅读最终的文本。
致谢
本研究由黑龙江省普通高等学校骨干教师创新能力资助计划、黑龙江省自然科学基金(C0014)、哈尔滨市学科后备带头人基金(0071007002)提供资助。
参考文献
Budar F., Thia-Toong L., Van Montagr M., and Hernalsteens J.P., 1986, Agrobacterium-mediated gene transfer results mainly in transgenic plants transmitting T-DNA as a single Mendelian factor, Genetics, 114(1): 303-313
PMid:17246346 PMCid:1202937
Cheng X.H., Dai D.P., Liu F., and Yao L., 2001, True leaf tissue culture and plant regeneration of Chinese cabbage, Zhiwu Shenglixue Tongxun (Plant Physiology Communications), 37(4): 310-311(成细华, 戴大鹏, 刘凡, 姚磊, 2001, 大白菜真叶的组织培养及植株再生, 植物生理学通讯, 37(4): 310-311)
Devos S., Vissenberg K., Verbelen J.P., and Prinsen E., 2004, Infection of Chinese cabbage by Plasmodiophora brassicae leads to a stimulation of plant growth: impacts on cell wall metabolism and hormone balance, New Phytologist, 241-249 doi:10.1111/j.1469-8137.2004.01304.x PMid:15760367
Hua Z.H., Zhu X.F., Wu G.M., Yu Y.C., Zhao Y., Gao Z.Y., Yan M.X., Qian Q., and Huang D.N., 2003, Inheritance of foreign genes Integrated into the rice genomes, Zuowu Xuebao (ACTA Agronomica Sinica), 29(1): 44-48 (华志华, 朱雪峰, 吴明国等, 于彦春, 赵艳, 高振宇, 颜美仙, 钱前, 黄大年, 2003, 水稻转基因整合模式中外源基因的遗传规律, 作物学报, 29(1): 44-48)
Ji X.Y., Yu L.J., Wang C.L., and Peng H.Y., 2009, Molecular detection and field analysis of transgenic tomato with interleukin-4 gene, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 7(3): 1-5(及晓宇, 于丽杰, 汪春蕾, 彭洪雨, 2009, 转il-4基因番茄的分子检测及田间分析, 分子植物育种, 7(3): 1-5)
Li H.M., Rotter D., Bonos S.A., Meyer W.A., and Belanger F.C., 2005, Identification of a gene in the process of being lost from the genus agrostis, Plant Physiology, 138(4): 2386-2395 doi:10.1104/pp.105.063297 PMid:15995002 PMCid:1183424
Ling C.Y., Yu L.J., and Tao L., 2005, A method of abstracting DNA from transgenic Chinese cabbage, Mudanjiang Shifan Xueyuan Xuebao (Journal of Mudanjiang Teachers College), 2: 19-20 (凌春莹, 于丽杰, 陶雷, 2005, 适于转基因大白菜检测的DNA高效提取方法, 牡丹江师范学院学报, 2: 19-20)
Londo J.P., Bollman M.A., Sagers C.L., Lee E.H., and Watrud L.S., 2011, Changes in fitness-associated traits due to the stacking of transgenic glyph sate resistance and insect resistance in Brassica napus L., Heredity, 3: 1038-1045
Lu Y.E., Li H.X., and Ye Z.B., 2003, Hormones to promote Chinese cabbage TDZ next hypocotyls change after treatment in vitro shoots regeneration effect analysis, Huazhong Nongye Daxue Xuebao (Journal of Huazhong Agricultural University), 22(6): 591-594(卢永恩, 李汉霞, 叶志彪, 2003, 激素TDZ对促进白菜下胚轴不定芽再生的效应分析, 华中农业大学学报, 22(6): 591-594)
Lv J., Zhu L.Q., and Wang X.J., 2001, Use protein kinase inhibitors and activators regulation cabbage selfing not affinity, Yuanyi Xuebao (Acta Horticulturae Sinica), 28(3): 235-239 (吕俊, 朱利泉, 王小佳, 2001, 利用蛋白激酶抑制剂和激活剂调控甘蓝自交不亲和性, 园艺学报, 28(3): 235-239)
Peng J., 2004, Study on the process of fertilization and its durationof each stage in Brassica pekinensis, Thesis for Master Degree, Harbin Normal University, Supervisor: Shen J.H., pp.11-17(彭杰, 2004, 大白菜受精过程及其各阶段持续时间的研究, 硕士学位论文, 哈尔滨师范大学, 导师: 申家恒, pp.11-17)
Sambrook J., Frisch E.F., and Maniatis T., eds., Jin D.Y., and Li M.F., trans., 1992, Molecular Cloning, Science Press, Beijing, China, pp.19-22
Shen S.X., Hou X.L., and Zhang C.H., 2006, Using the isolated microspore culture create Chinese cabbage primary 3 body of research, Yuanyi Xuebao (Acta Horticulturae Sinica), 33(6): 1209-1214(申书兴, 侯喜林, 张成合, 2006, 利用小孢子培养创建大白菜初级三体的研究, 园艺学报, 33(6): 1209-1214)
Wally O., Jayaraman J., and Punja Z.K., 2008, Comparative expression of β-glucuronidase with five different promoters in transgenic carrot (Daucus carota L.) root and leaf tissues, Plant Cell Rep., 27(2): 279-287 doi:10.1007/s00299-007-0461-1 PMid:17924115
Wang L., Yu L.J., Ling C.Y., and Li R.H., 2006, Primary study on transgenic chinese cabbage with Interleukin-4 gene via pollen-tube pathway, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 4(6): 805-810 (王雷, 于丽杰, 凌春莹, 李然红, 2006, 花粉管通道法介导il-4基因转化大白菜(Brassica pekinensis Rupr.)的研究初探, 分子植物育种, 4(6): 805-810)
Wang Y., Cui J.Z., and Li C.L., 2005, High-frequency regeneration system establishment and strategy of Chinese cabbage, Yuanyi Xuebao (Acta Horticulturae Sinica), 32(4): 701-703 (王洋, 崔继哲, 李翠玲, 2005, 大白菜高频再生体系的建立及策略, 园艺学报, 32(4): 701-703)
Wu D., and Zhu Y.M., 2002, The reasons of plant transgenic silence and the countermeasures, Shengwu Jishu Tongxun (Letters in Biotechnology), 13(3): 228-231(吴迪, 朱延明, 2002, 转基因植物中外源基因沉默机制及防止对策, 生物技术通讯, 13(3): 228-231)
Xie J.K., Cui H.R., Shu Q.Y., Xia Y.W., and Shou S.Y., 2001, Cabbage insect-resistant genes into receptor system is established, Yuanyi xuebao (Acta Horticulturae Sinica), 28(2): 175-176(谢建坤, 崔海瑞, 舒庆尧, 夏英武, 寿森炎, 2001, 白菜抗虫基因转化受体体系的建立, 园艺学报, 28(2): 175-176)
Yang G.D., Zhu Z., Li Y.E, Zhu Z.J., Xiao G.F., and Wei X.L., 2002, Chinese cabbage turns modified cowpea pancreatic protein inhibitors genes get insect resistance plants, Yuanyi Xuebao (Acta Horticulturae Sinica), 29(3): 224-228(杨广东, 朱祯, 李燕娥, 朱祝军, 肖桂芳, 魏晓丽, 2002, 大白菜转修饰豇豆胰蛋白抑制剂基因获得抗虫植株, 园艺学报, 29(3): 224-228)
Zhao J.L., 2006, Improvement of insect-resistance and disease-resistance of Chinese cabbage by genetic engineering, Thesis for Dr. Degree, Shanxi University, Supervisor: Liang A.H., pp.20-25 (赵军良, 2006, 基因工程改良大白菜的抗虫抗病性研究, 博士学位论文, 山西大学, 导师: 梁爱华, pp.20-25)